研究テーマ
(1)タンパク質の発現向上、巻き戻し効率向上に役立つスタビロンモチーフの開発
(2)組換え体タンパク質製剤の開発 〜難治性疾患、再生医療への応用〜
(膜透過性タンパク質、組み換え抗体など)
(3)COMMD5の機能解析
(4)日焼けによるがん予防法の確立
(5)短日植物の花芽形成機構の解明

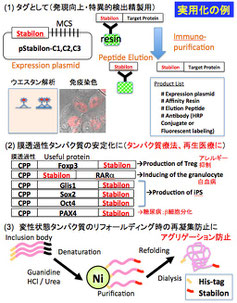
(1)タンパク質の発現向上・安定化、巻き戻し効率向上に役立つスタビロンモチーフの開発
以前の研究において、ヒトの転写因子DP-1(細胞周期のG1期から S期への移行を促進)のC末端側にDP-1の安定化に重要な領域を見つけ“スタビロン”と名付けました。この領域を削ると、DP-1タンパク質の発現はほとんど見られなくなります!この結果があまりにも顕著であったことから、“他のタンパク質に応用できないか!?”と考えました。実際に研究室にあったいくつかのタンパク質に融合し確かめてみると、多くのタンパク質で発現が上昇しました。
そこで、この領域をタンパク質発現向上用のタグとして実用化することを考えました。しかし、DP-1の配列のままでは、内因性のDP-1を検出してしまうことから、DP-1スタビロンを構成する4つのアミノ酸の順列を変更し、データベースに既存の生物種中にはない配列を考えました。更に、その中からスタビロン効果が高いものをスクリーニングしました。発現系として実用化を目指すためには、特異的に結合する良質な抗体も重要です。そこで、選んだ候補配列を抗原にモノクローナル抗体も作製しました。現在、このモノクローナル抗体を用いた免疫沈降精製時に用いる溶出用のペプチドや溶出条件の検討を行っています。
私達が開発中のスタビロンモチーフは動物細胞内で多くのタンパク質を安定化させますが、植物や昆虫、酵母、バクテリアでどう働くかは不明です。今後生物種の汎用性を広げる意味でも検討したいと考えています。また、スタビロンモチーフは酸性アミノ酸が多いため、融合したタンパク質の等電点を下げる効果があります。よって、尿素やグアニジン塩酸で変性したタンパク質(大腸菌発現系で封入体発現したタンパク質の精製でよく用います)の巻き戻し時に可溶度を上昇させる(再凝集を防ぐ)効果があると考えられます(塩基性タンパク質の方が再凝集し易いため)。
また、現時点ではスタビロンがどのようなメカニズムでタンパク質を安定化させるのかは不明であることから、この解明にも取り組みます。現在は、ショットガンMS-MS解析による相互作用因子群の同定を行っています。
本スタビロン融合システムがうまくいけば、翻訳後修飾が必要なタンパク質の真核生物細胞を利用した量産等に役立てることができるのではないかと考えています。

(2)組換え体タンパク質製剤の開発 〜難治性疾患、再生医療への応用〜(膜透過性タンパク質、組み換え抗体、ワクチンなど)
医学が発展してきた現在でも難治性疾患は数多く存在します。従来、多くの疾患では化合物による製剤開発が盛んでしたが、近年ではペプチドやタンパク質製剤の開発も盛んになっています。これまでに製剤化されたタンパク質は成長ホルモン(成長を促す)、インスリン(血糖値を下げる)、エリスロポエチン(赤血球を増やす)や抗体製剤(PD-1抗体、IL-6R抗体)など、血液中のタンパク質が中心です。しかし、これらのみでは適応する疾患が少なくなります。そこで本研究では、細胞膜透過性組換え体タンパク質技術を応用し、細胞内のタンパク質を補充したり、生体に悪影響を及ぼすタンパク質を除去したりする方法の開発を目的とします。また、この技術は、細胞の分化、未分化化制御にも役立てられると考えます。
現在本研究室では、
[i]iPS細胞誘導法・維持法の確立;分解耐性型山中因子(Sox2, Oct4, klf4, Glis1, nanog)+ bFGF, CCL2 + ケミカル
[ii]COMMD5発現系の確立
[iii]サイトカインシグナル抑制因子(SOCS)発現系の確立
[iv]分解促進型抗体の開発(悪玉タンパク質の除去);アルツハイマー型認知症関連のタンパク質除去
[v] 急性前骨髄球性白血病(APL)改善用の組換え体タンパク質発現系の構築
[vi]組換え体を使用したワクチン開発
を中心に研究を進めています。
発現系としては主に大腸菌発現系を用います。これは後々、工業的スケールでの発現に応用し易いためです。しかし、大腸菌発現系では異種発現により低発現になったり、封入体発現となることも多々あります。このような場合は、ペリプラズム(細胞壁と細胞膜の間)への局在化や他宿主(ブレビバチルス、酵母、昆虫細胞、等々)での発現も試みたいと思います。
また、最近は種々の細胞膜透過性タグや、エンドサイトーシス時にリソソームに向かわず(※1)細胞質に入り込みやすくなるタグなども開発されていることから、これらの応用も試みます。
※1;細胞膜透過性タンパク質による細胞内導入は主にエンドサートーシスで入ると考えられている。しかし、エンドサイトーシスは栄養源の取り込みなどが目的であるため、細胞膜に囲まれた搬入物はリソソームと融合し分解される。すなわち、多くの膜透過性タンパク質も細胞内導入後、機能する前に分解されてしまう。
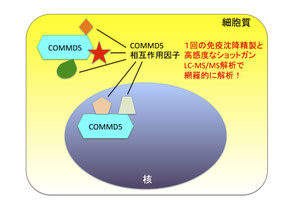
(3)COMMD5の機能解析
COMMD5はHCaRG (Hypertension-related, Calcium-Regulated Gene)とも呼ばれ、細胞外のカルシウムによって発現制御される遺伝子群のファミリーの1因子で、高血圧時に発現が上昇するタンパク質であると考えられています。また、近年では腫瘍抑制や腎機能修復にも重要だと考えられています。しかし、COMMD5が細胞内で相互作用する因子群に関する知見が少ないことから、細胞内でどのように機能しているか不明な点があります。そこで、本研究ではHEK293T細胞にタグ付きのCOMMD5の遺伝子を導入し、これを恒常的に発現する細胞を作製しました。更に、このタグの抗体レジンを用いた免疫沈降精製を行いました。少し前の研究では、この段階の精製物をそのままMS解析に供して分析しても、夾雑物が多くなかなかいい解析ができませんでした。その場合、2次元電気泳動で分離したり、2回目の液体クロマトグラフィーを行ったり、抽出液を数画分に分けた後に免疫沈降精製を行ったりと、様々な工夫が必要でした。しかし、これらの操作を行っても解像度が悪い、ロスが多い(元の細胞の大量培養が必要になる)などが問題となり、精度のいい解析は困難でした。
私達は近年開発された高感度のショットガンLC-MS/MS解析を用い、ワンステップの免疫沈降精製産物を直接解析することにしました。この場合、レジンや抗体に結合するタンパク質も多く検出されるため、比較体によるこれらの引き算が重要になってきます。これを工夫し(比較体を複数用いる)、実験したところ、既知の相互作用因子を含む多数の期待できる候補因子が挙がってきました。今後、これらについて、in vitro、in vivoの実験を行い、相互作用の正確性や機能の変動に関する検証実験をおこなっていきます。
また、細胞膜透過性COMMD5の発現系構築にも取り組みます。この研究は、本学医学部、松田裕之先生との共同研究です。


(4)日焼けによるがん予防法の確立
現代社会は長寿命化が進み、2人に1人ががんになってしまう時代です。がんに罹患すると精神的なショックも大きく、様々な治療を受けなくてはいけなくなります。このようなことからも、がんに対しては“予防法の確立”が重要だと考えます。
これまでに、胃がんはピロリ菌感染、肝がんは肝炎ウイルス感染が主な原因であることが判明してきています。このような場合は、除菌や除ウイルスが有効な手段だと考えられます。
一方、乳がん、肺がん、直腸がん等では日照との関係が報告されています。日照は誰でも比較的容易に受けることができることから、非常にいい予防法になるのではないかと考えています。しかし、どの程度の日焼けがどの時期(成長過程の)に必要なのかという指標がはっきりしません。また、がんの発症には非常に多様な機構が関与しています。本研究ではこのような視点から研究を進めたいと思います。また、本研究機関は臨床系の機関ではないことから、これらの研究をされているいくつかの研究機関の研究者の方々と共同で研究を進めたいと考えています。
一般的には、日焼けによりビタミンDが皮膚で合成されると免疫系の活性が高まるためがん予防効果が高いのではと考えられていますが、この一連のメカニズムは明確ではありません。本研究では日焼けに伴うビタミンDのシグナル伝達系や免疫系の変動を調べると同時に、遺伝子修復酵素群、癌抑制因子群の活性変動にも着目し、研究を進めたいと考えています。
本研究では、本学医学部生化学分野、石澤通康先生(本学科の出身)と共同研究を行います。

(5)短日植物の花芽形成機構の解明
植物の中には日長により開花が制御(光周的花成)される植物があります。日長が次第に長くなると咲く植物を長日植物(シロイヌナズナ、アブラナ、ダイコン、ホウレンソウ、クローバー、等々)、短くなると咲く植物が短日植物(オナモミ、アメリカセンダングサ、コスモス、アサガオ、イネ、キク、等々)といいます。
短日植物では、以前はオナモミが実験材料としてよく使用されてきました。しかし、現在、オナモミは神奈川以西ではほとんど見かけることができなくなってきています(温暖化の影響でしょうか?)。そこで本研究では、同じような性質を持つアメリカセンダングサ、コセンダングサを対象として研究を進めたいと考えています。
オナモミやアメリカセンダングサ、コセンダングサは夜の長さが一定以上になると花芽形成が始まります。この時間を限界暗期と呼んでいます。
本研究では、
[i]アメリカセンダングサ、コセンダングサの限界暗期が何時間何分か?
[ii] 1度の限界暗期処理で花芽形成は可能か?
[iii] 花芽形成が可能になる栄養成長期はどこまでか?
[iv] 限界暗期処理中の植物個体への花芽誘導因子導入で花芽形成可能か?
[v] 花芽形成誘導物質や遺伝子は何か?
[vi] ゲノムDNAの配列や染色体構造は?
などに関して研究を行います。
すなわち、細胞の分化・増殖を中心に研究します。光周性依存的分化、プログラム分化、生殖細胞の分化、等です。本研究では通常の生化学・分子生物学的解析も行いますが、植物の透明化試薬を用いた顕微鏡観察(主に共焦点レーザー顕微鏡)も行います。

ただ、アメリカセンダングサやコセンダングサのみを扱っていても見えてこないメカニズムをあると思うので、比較対象をいろいろ考えます。まず、以前の研究が役に立てられること、同じキク亜科であることから、オナモミを扱います。オナモミは現在、神奈川県以西では激減していますが、一部には存在すること、茨城県や福島県以北でも見られることから、これらの生態観察も同時に行います。実験的な栽培は、野外プランター(4号館前)、室内鉢(4号館1階の総研内)で主に行いますが、農場や、野外株の観察も行います。以前の研究結果は限界暗期の測定において、薄暮期の扱いが一定でないことから、やや混乱を招いています。本研究では室温がコントロールできる恒温室で、植物専用育成ライトとタイマーを使用し、厳密な限界暗期の測定を行います。更に、花芽誘導物質の合成期が判明してきた場合、メタボローム解析やプロテオーム解析を行い、分子種の同定やメカニズムの解明を行いたいと思います。また、既知の花成関連遺伝子(FT, FD, CONSTANS, AP1等々)に関して、RNA-seq解析や細胞膜透過性技術を応用し実験することも考えています。尚、細胞膜透過性タンパク質に関しては(植物以外のタンパク質でも)、鳥取大学農学部生体制御化学研究室の、岩崎崇先生と共同研究を行います。特に、ポリヒスチジンタグを利用した細胞膜透過性技術の開発です。
また、なかなか花を咲かせないサツマイモ(イモ自体で増やすことが可能)や竹(地下茎で増える)なども研究対象にします。
この他にも長日植物では、モデル植物であるシロイヌナズナも対象として考えます。本学科では植物細胞学研究室で栽培されていることから、共同研究を行います。
現在、いろいろな植物で全ゲノム解析が進んでいます。あと10年もすると相当数の種で揃ってくるのではないかと考えられます。本研究でもこれらの成果を利用し、ゲノムの進化上花や種子の獲得はどのように進んだのかについても考えたいと思います。
[ 研究をエンジョイ!]

『進化を考える鉢』を作製!
現在の地上植物は約5億年前に地上に進出し、約2億年前に花を獲得したと考えられています。そして現在では、地上の9割もの植物が被子植物(花を咲かせる)であると考えられています。花は土や枯れ草、緑の植物と対比すると鮮やかな色彩を放っています。これにより、昆虫や鳥を集め、生殖を促進させたと考えられます。植物は花を獲得する際、このような昆虫や鳥を意識して進化したのでしょうか?植物には神経はないので、他生物の存在を感じたりそれにあわせて形態を変化させたりというのは難しいように思います。突然変異や染色体重複、ウイルス感染、トランスポゾンなどにより幾つかの種類が発生し、適応した種のみが生き残るような自然淘汰によるものでしょうか?
このようなことを考えるのに、机上の(もしくはコンピューター中の)データのみで考えていては息が詰まりそうです。そこで、研究をエンジョイするために、寄せ植えの鉢を作製してみました。現在は鉢の中心にシダ植物、その周辺に、コケ植物(ギンゴケ、ゼニゴケ、スギゴケ[今後導入予定])、マンネングサ属(マンネングサ、ツルマンネングサ)を配置し栽培しています。これは、花の獲得の進化過程を考える配置です。
コケやマンネングサは道端、河川周辺等、比較的街中でも見かけられる植物です。ちょっとした散歩や通勤通学途中でも、少し気をつければ発見できます。また、見つけた植物を地図に記入しておけば、ちょっとしたマッパーにもなれます。また、同じ植物を時間を追って観察(定点観察)すると、その生長具合も面白くなってきます。最近これらの植物はコケ玉やコケリウム、観葉植物としても大変人気になっています。ある種のコケやマンネングサは軽い上に乾燥にも強いので、都会の緑化にも役立つかもしれません。
これらの植物の生活環や生殖方法の違いなどを遺伝子の進化やタンパク質、RNAの働きなども含めて考えながら、研究を進めたいと考えています。

比較で進化を考える!
短日植物の代表にアサガオがあります。アサガオはご存知の通り、夏休みの朝に花が咲きますが、この頃は既に夏至(6月22日頃)をだいぶん過ぎており、日長は短くなっています。アサガオに似た植物にヒルガオがありますが、ヒルガオは5月くらいに花が咲きます(長日植物かは不明?)。アサガオの花は昼にはしぼんできますが、ヒルガオは昼間咲き続けます。また、サツマイモは滅多に花が咲きませんが、咲く場合は7月下旬から8月上旬頃に咲きます。弱い短日植物だと考えられています。
これらはいずれも、キク類・ナス目・ヒルガオ科に属し、葉や花の形も類似しているので、遺伝的には近いものと考えられます。そこでこれらを比較すると、光周性の変動は何が原因で起きたのか?サツマイモの花はを獲得した後に不要になったのか?それはイモをタネとして増殖させることができるためなのか(イモが目当ての栽培時には一般的にツルで増やします)?イモは竹の地下茎やタケノコ、イチゴのランナー等とは性質が違うのか?などなどいろいろ考えることが増えてきます!
このような疑問を他の人も同様に考え既に解明しているのだろうか?と思い既報の論文を読みあさるのも楽しいです。仮にまったく発表や報告がない場合、自分がそのデータをとって報告すれば第1発見者になれます。しかし、データ発表や公表には一定の作法があります。大学の研究室ではそのような作法を身につけられます。その作法を身に付けた上で、実験を重ね、公表していけばきっといいサイエンスができると思います。
私達の研究室では、花芽形成のきっかけとなるメカニズムを見つけた際には、普段もしくは日長の制御で強制的に咲かない状態の植物に導入してみて、そのセオリーが本当かどうかを確認することもしてみたいと考えています。

"コ"センダングサは小さくない!!
現在、質的短日植物の代表的な種類として、本研究でも扱っているコセンダングサですが、本学部の農場に行くと、もの凄い大きさの個体(3m越え!)があります。一般的には50cm〜2mくらいの個体が多いです。全国的にいろいろ観察してますが、3mを超える個体は初めて見ました。暫定世界一記録としてみんなで記念撮影して楽しんでいます。
実は世界的に著名な植物生理学の本に3m越えの植物個体の物差しとして1人の人を肩に乗せた2人の学生さんが写っている写真があります。世界中考えることは同じなんだなと思いました。
(この写真は2019年10月8日撮影、この数日後台風で折れてしまいました!)
ちなみに、類似種のアメリカセンダングサも3mを越す個体を近所で見つけています。